บทนำ
ปัจจุบันการใช้วัสดุจากธรรมชาติที่มีความปลอดภัยต่อสุขภาพและสิ่งแวดล้อมกำลังได้รับความสนใจอย่างสูง หนึ่งในนั้นคือ สารพอลิเมอร์ธรรมชาติ (natural polymer) ได้แก่ สารพอลิแซ็กคาไรด์ (polysaccharide) ที่มาจากผลผลิตทางการเกษตรหรือเปลือกแข็งของสัตว์น้ำที่เหลือทิ้ง เช่น เซลลูโลส (cellulose) แป้ง เพกติน (pectin) รวมทั้งไคตินและไคโตแซน (chitin and chitosan) ประโยชน์และข้อดีของสารพอลิเมอร์ธรรมชาติดังกล่าวมีหลายประการ เช่น ผลิตจากวัตถุดิบที่มีอยู่มากมายในธรรมชาติทั้งจากผลผลิตทางการเกษตรหรือผลิตผลทางทะเล นอกจากนี้สารพอลิเมอร์ธรรมชาติยังเข้ากับธรรมชาติได้ดีและย่อยสลายได้เองจึงมีความปลอดภัยต่อสิ่งแวดล้อมและสามารถดัดแปลงโดยใช้ปฏิกิริยาทางเคมีหรือเอนไซม์ให้มีคุณสมบัติที่เหมาะสมกับการใช้งานเฉพาะอย่างได้ ซึ่งไคตินและไคโตแซนเป็นพอลิเมอร์ธรรมชาติที่น่าสนใจ สามารถผลิตได้จากเปลือกแข็งของสัตว์น้ำจำพวกกุ้งและปูเป็นหลัก และยังสามารถสกัดไคตินและไคโตแซนโดยใช้จุลินทรีย์จำพวกพวกเห็ดรา (fungi) ได้ด้วย
ไคโตแซน เป็นอนุพันธ์ของไคตินและผลิตได้จากปฏิกิริยาการกำจัดหมู่แอซิติลของไคตินไคโตแซนมีองค์ประกอบเป็นกลูโคซามีน (glucosamine) และเอ็น-แอซิติลกลูโคซามีน (N-acetyled glucosamine) เชื่อมต่อกันเป็นสายพอลิเมอร์ด้วยพันธะ (1-4) - กลูโคสิดิก [(1-4) glucosidic bonds] ทั้งปริมาณและลำดับของหน่วยย่อยเหล่านี้เป็นตัวกำหนดคุณสมบัติต่างๆ ของไคโตแซน ไคโตแซนที่ผลิตได้มีหลายรูปแบบและมีคุณสมบัติต่างกันออกไป สามารถถูกดัดแปลงโครงสร้างเกิดเป็นอนุพันธ์ของไคโตแซนได้หลายชนิด ไคโตแซนและอนุพันธ์ของไคโตแซนได้ถูกนำมาใช้ประโยชน์อย่างหลากหลายทั้งในด้านเกษตรกรรม อาหาร ยาและวัสดุศาสตร์ เป็นต้น ในด้านอาหารไคโตแซนได้ถูกนำมาใช้โดยการเติมลงในผลิตภัณฑ์หรือใช้เคลือบผิวเพื่อถนอมคุณค่าและยืดระยะเวลาของการเก็บรักษา มีงานวิจัยมากมายที่ได้ทำการศึกษาถึงประโยชน์ของการใช้ไคโตแซนในอาหาร รายงานฉบับนี้ได้รวบรวมรายละเอียดของแหล่งวัตถุดิบ กระบวนการผลิตและคุณสมบัติที่สำคัญของไคโตแซน ตลอดจนข้อมูลการนำไคโตแซนมาใช้ประโยชน์เพื่อรักษาคุณค่าและยืดอายุของการเก็บรักษาอาหารและเครื่องดื่ม
คำนิยามและองค์ประกอบของไคโตแซน (Definition and composition of chitosan)
ไคโตแซนจัดเป็นสารพอลิเมอร์ธรรมชาติและเป็นอนุพันธ์ของไคติน ไคโตแซนมีองค์ประกอบเป็นกลูโคซามีน (glucosamine) และ เอน-แอซิติลกลูโคซามีน (N-acetyled glucosamine) เป็นหน่วยย่อยที่เรียงต่อกันเป็นสายด้วยพันธะ (1-4) - กลูโคสิดิก [(1-4) glucosidic bonds] (รูปที่ 1) จำนวนและลำดับของหน่วยย่อยในสายพอลิเมอร์จะเป็นตัวกำหนดคุณสมบัติทางเคมี กายภาพและชีวภาพของไคโตแซน
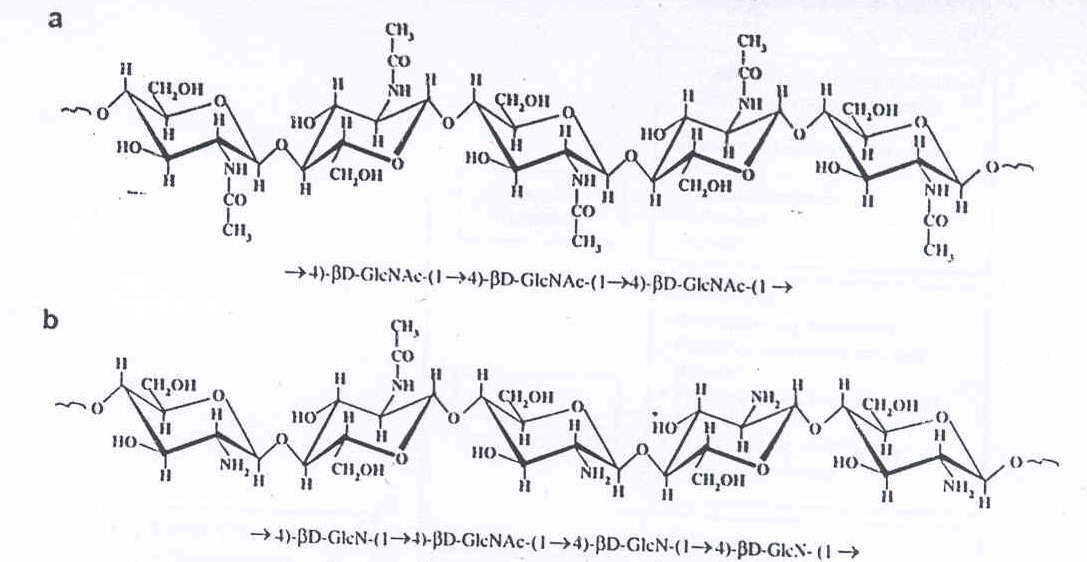
รูปที่ 1 โครงสร้างของไคติน (a) และไคโตแซน (b) (Harish Prashanth, KV. and Tharanathan, RN., 2007)
ลักษณะเฉพาะของไคโตแซน (Characteristics of chitosan)
1. ระดับการกำจัดหมู่แอซิติล (Degree of deacetylation, DD) ไคโตแซนเกิดจากปฏิกิริยาการกำจัดหมู่แอซิติลของไคติน (พอลิเมอร์สายยาวที่มีองค์ประกอบเป็น เอน-แอซิติลกลูโคซามีน) สภาพของการเป็นไคโตแซนจึงขึ้นอยู่กับปริมาณการการเกิดปฏิกิริยากำจัดหมู่แอซิติล ซึ่งวัดได้จากค่าระดับการกำจัดหมู่แอซิติล การลดลงของหมู่แอซิติลในไคตินเป็นการเพิ่มขึ้นของหมู่อะมิโนของกลูโคซามีนซึ่งเป็นการเพิ่มประจุบวกบนสายพอลิเมอร์ทำให้เกิดสภาพของการเป็นไคโตแซนเพิ่มขึ้น การจัดระดับของการกำจัดหมู่แอซิติลของไคโตแซนมีค่าเป็นร้อยละหรือที่เรียกว่า Percent Deacetylation (% DD) ค่าระดับการกำจัดหมู่แอซิติลของไคโตแซนมีผลต่อคุณสมบัติต่างๆ ของไคโตแ
2. คุณสมบัติในการยับยั้งเชื้อจุลินทรีย์ (Antimicrobial properties) (Harish Prashanth and Tharanathan, 2007) ไคโตแซนและอนุพันธ์ของไคโตแซนมีคุณสมบัติในการยับยั้งการเจริญของจุลินทรีย์หลายชนิด เช่น แบคทีเรีย ยีสต์และรา ไคโตแซนจึงได้รับความสนใจอย่างมากในการนำมาใช้ประโยชน์เพื่อป้องกันการเสื่อมสภาพและยืดระยะเวลาในการเก็บรักษาอาหารหลายชนิด เช่น อาหารทะเล เนื้อสัตว์ ผักและผลไม้ นม ขนมปัง และน้ำผลไม้ (No, HK., et al., 2007)
จากการศึกษาฤทธิ์ของไคโตแซน (94% DD, 43 kDa) ในการยับยั้งเชื้อจุลินทรีย์ชนิดต่างๆ ที่พบในอาหารที่ความเข้มข้น 40-750 mg/l (Devlieghere, F., Vermeulen, A., and Debevere, J., 2004) พบว่า แบคทีเรียแกรมลบมีความไวสูงต่อไคโตแซน ในขณะที่ความไวของแบคทีเรียแกรมบวกจะแตกต่างกันมากและยีสต์มีความไวปานกลาง นอกจากนี้ยังพบว่าประสิทธิภาพในการยับยั้งเชื้อจุลินทรีย์ของไคโตแซนลดลงเมื่อค่าความเป็นกรด-ด่าง (pH) สูงขึ้น องค์ประกอบของอาหาร เช่น แป้ง โปรตีน และเกลือโซเดียมคลอไรด์ (NaCl) มีผลเสียต่อการยับยั้งเชื้อจุลินทรีย์ ส่วนไขมันไม่พบว่ามีผลกระทบใดๆ งานวิจัยของ ดร. บุญศรี จงเสรีจิตต์ และคณะ (2547) พบว่าไคโตแซนที่ความเข้มข้น 100-3,000 ส่วนในล้านส่วน (part per million, ppm) สามารถยับยั้งเชื้อแบคทีเรีย S.aureus, E.coli, S. typhimurium ได้อย่างมีประสิทธิภาพโดยมีค่าความเข้มข้นน้อยที่สุดของไคโตแซน (minimal inhibitory concentration, MIC) ในการยับยั้งการเจริญของแบคทีเรียเท่ากับ 100, 500 และ 1,000 ppm ตามลำดับ แต่สามารถยับยั้งการเจริญของเชื้อ V. parahaemolyticus ได้เพียง 70% และยับยั้งเชื้อ V. cholerae ได้ต่ำมาก
สำหรับกลไกการยับยั้งการเจริญของจุลินทรีย์ ได้มีผู้รวบรวมเสนอไว้หลากหลาย (Harish Prashanth, KV. and Tharanathan, RN., 2007) ไคโตแซนอาจยับยั้งเชื้อจุลินทรีย์โดยอนุภาคประจุบวกบนโมเลกุลของไคโตแซนสามารถจับกับอนุภาคประจุลบบนผนังเซลล์ของจุลินทรีย์ ทำให้ผนังเซลล์เกิดความเสียหายขึ้นจนไม่สามารถควบคุมการผ่านเข้าออกของสาร จึงเกิดการรั่วไหลของสารต่างๆในเซลล์และทำให้เซลล์ตายในที่สุด นอกจากนี้ยังพบว่าฤทธิ์ในการต้านจุลินทรีย์อาจเป็นผลมาจากการขัดขวางสารอาหารเข้าสู่เซลล์ ไคโตแซนบางชนิดโดยเฉพาะชนิดที่มีน้ำหนักโมเลกุลต่ำ เมื่อเคลื่อนเข้าสู่เซลล์ของจุลินทรีย์จะไปจับกับ DNA จึงยับยั้งการสังเคราะห์ RNA และโปรตีน หรืออาจจับกับอิออนของโลหะ (chelation) และสารอาหารที่จำเป็น นอกจากนี้ประสิทธิภาพในการยับยั้งการเจริญของจุลินทรีย์ขึ้นอยู่กับขนาดน้ำหนักโมเลกุล ค่าระดับการกำจัดหมู่อะซิทิล ชนิดของจุลินทรีย์หรือแบคทีเรีย ชนิดของสารละลายกรดที่ใช้ ชนิดของอาหารและอุณหภูมิในการเก็บรักษา องค์ประกอบของอาหาร เช่น คาร์โบไฮเดรต โปรตีน ไขมัน เกลือแร่ เกลือ อาจทำปฏิกิริยากับไคโตแซนและส่งผลให้ประสิทธิภาพในการยับยั้งการเจริญของจุลินทรีย์เพิ่มขึ้นหรือลดลงได้ (นภาพร เชี่ยวชาญ และธนารัตน์ ศรีธุระวานิช, 2547) การดัดแปลงโมเลกุลของไคโตแซนมีผลต่อการยับยั้งจุลินทรีย์ด้วยเช่นกัน อนุพันธ์ของไคโตแซนหลายตัว เช่น dietylmethylchitosan, N,O-acylchitosan และ hydroxypropylchitosan มีฤทธิ์ยับยั้งแบคทีเรียและเชื้อราได้ดีกว่าไคโตแซน
3. การทำเป็นแผ่นหรือเยื่อบาง (Formation of film) ไคโตแซนและอนุพันธ์ของไคโตแซนหลายชนิดมีคุณสมบัติในการนำมาขึ้นรูปเป็นแผ่นฟิล์มหรือเป็นเยื่อบางๆ ที่มีความเหนียว คงทน ยืดหยุ่นและไม่ฉีกขาดง่าย แผ่นฟิล์มมีลักษณะเด่นในการป้องกันการสูญเสียน้ำหรือความชื้นและควบคุมการผ่านเข้าออกของก๊าซได้ดี สามารถรับประทานได้ ไม่เป็นพิษและย่อยสลายได้ในธรรมชาติ นอกจากนี้ยังมีคุณสมบัติยับยั้งการเจริญของจุลินทรีย์หลายชนิด (นภาพร เชี่ยวชาญ และธนารัตน์ ศรีธุระวานิช, 2547; Harish Prashanth, KV. and Tharanathan, RN., 2007) จึงมีการนำไปใช้ประโยชน์เป็นบรรจุภัณฑ์หรือเคลือบบนผิวของอาหารเพื่อชลอการเน่าเสียและถนอมคุณค่าของอาหาร เช่น ผลไม้ เนื้อสัตว์ และเนยแข็ง ไคโตแซนเป็นสารที่ไม่ละลายน้ำ ดังนั้นการทำแผ่นฟิล์มไคโตแซนต้องใช้กรดอินทรีย์เพื่อเป็นตัวทำละลาย เช่น กรดอะซิติก (acetic acid) กรดแลคติก (lactic acid) กรดฟอร์มิก (formic acid) กรดโพรพิออนิก (propionic acid) และกรดมาลิก (malic acid) เมื่อละลายในกรดอินทรีย์จะได้สารละลายไคโตแซนที่มีความหนืดต่างๆ ขึ้นอยู่กับชนิดของกรดที่ใช้ทำละลายและจะมีอิทธิพลต่อคุณสมบัติของแผ่นฟิล์มหรือการเคลือบไคโตแซน ประกอบกับกรดอินทรีย์เหล่านี้ยังมีคุณสมบัติในการยับยั้งการเจริญของจุลินทรีย์ในตัวของกรดเอง จึงช่วยเสริมฤทธิ์ในการต้านเชื้อจุลินทรีย์ของไคโตแซนยิ่งขึ้น ประสิทธิภาพในการการยับยั้งการเจริญของจุลินทรีย์ขึ้นอยู่กับชนิดของกรดอินทรีย์ โดยไคโตแซนที่ละลายในกรดอินทรีย์ต่างชนิดกันจะมีประสิทธิภาพในการยับยั้งการเจริญของจุลินทรีย์แตกต่างกันไปด้วย มีรายงานว่าไคโตแซนที่ละลายในกรดอะซิติก กรดแลคติกและกรดฟอร์มิก มีประสิทธิภาพในการยับยั้งการเจริญของแบคทีเรียมากกว่ากรดโพรพิออนิกและกรดแอสคอบิก (ascorbic acid) (นภาพร เชี่ยวชาญ และธนารัตน์ ศรีธุระวานิช, 2547)
การผสมสารบางชนิด เช่น น้ำมันหอมระเหยกรดสเตียริก (steric acid) และสารเชื่อมโยง (cross-linking agent) มีผลต่อประสิทธิภาพในการยับยั้งการเจริญของจุลินทรีย์ การผ่านเข้าออกของน้ำตลอดจนความยืดหยุ่น และความทนทานของแผ่นฟิล์มไคโตแซน (Mi, FL., et al., 2006; Moller, H., et al., 2004; Zivanovic, S., Chi, F., Draughon, AF., 2005) น้ำมันหอมระเหยออริกาโน (oregano essential oil) ทำให้แผ่นฟิล์มหนาและขุ่นขึ้น มีความแข็งแรงลดลงแต่มีความยืดหยุ่นสูงขึ้น และลดการซึมผ่านของน้ำได้ดีรวมทั้งเพิ่มประสิทธิภาพในการยับยั้งการเจริญของเชื้อ L. Monocytogene และ E. Coli ในแผ่นไส้กรอก (bologna slice) เก็บที่อุณหภูมิ 10 องศาเซลเซียส นาน 5 วัน ได้ดีกว่าเมื่อเปรียบเทียบกับแผ่นฟิล์มไคโตแซนเดี่ยวๆ (Zivanovic, S., Chi, F., Draughon, AF., 2005) นอกจากนี้ยังสามารถผลิตเป็นแผ่นฟิล์มแบบผสม (composite film) กับเซลลูโลส (chitosan-hydroxy propyl methyl cellulose film) ซึ่งมีคุณสมบัติในการยับยั้งการเจริญของเชื้อ Listeria Monocytogenes ซึ่งเป็นจุลินทรีย์ที่พบในอาหาร (Moller, H., et al., 2004)
ความแข็งแรงของแผ่นฟิล์มไคโตแซนและการป้องกันความชื้นเป็นคุณสมบัติที่สำคัญและเป็นข้อจำกัดของการใช้แผ่นฟิล์มไคโตแซน จากงานวิจัยต่างๆ พบว่าคุณสมบัติดังกล่าวขึ้นอยู่กับองค์ประกอบที่ใช้ในการผลิต เช่น ชนิดของกรด ค่าความเป็นกรด-ด่าง (pH) และอัตราการกำจัดหมู่แอซิติลของไคโตแซน รวมทั้งชนิดของสารที่ใช้เพื่อทำให้แผ่นฟิล์มเกิดความยืดหยุ่น (plasticizer) เช่น กลีเซอรอล (glycerol) หรือพอลีเอธิลีนไกลคอล (polyethylene glycol) (Suyatma, NE., Tighzert, L., and Copinet, A., 2005) แผ่นฟิล์มไคโตแซนที่ผลิตจากกรดไฮโดรคลอริก (hydrochloric acid ) และกรดอะซิติก จะมีเนื้อแน่นและเปราะบาง ในขณะที่ฟิล์มที่ทำจากกรดแลคติก (lactic acid) และกรดซิตริก (citric acid) จะมีความยืดหยุ่นสูงกว่า (Zivanovic, S., Chi, F., Draughon, AF., 2005) นอกจากนี้พบว่า แผ่นฟิล์มไคโตแซนที่มีระดับการกำจัดหมู่แอซิติลต่ำ (78.9%) จะมีการซึมผ่านของน้ำและมีปริมาณสารที่ละลายน้ำได้ (total soluble matter) ต่ำกว่าและมีความแข็งแรงต้านต่อแรงดึง (tensile strength) มากกว่าแผ่นฟิล์มไคโตแซนที่มีระดับการกำจัดหมู่แอซิติลสูง (92.3%) และแผ่นฟิล์มไคโตแซนที่มีระดับการกำจัดหมู่แอซิติลสูงจะเกิดการเปลี่ยนแปลงมากกว่าแผ่นฟิล์มไคโตแซนที่มีระดับการกำจัดหมู่แอซิติลต่ำเมื่อชนิดของกรดและค่าความเป็นกรด-ด่าง (pH) เปลี่ยนแปลงไป นอกจากนี้เมื่อค่าความเป็นกรด-ด่าง (pH 3, 4 และ 5) สูงขึ้นจะทำให้การซึมผ่านของน้ำและมีปริมาณสารที่ละลายน้ำได้เพิ่มขึ้นตามแต่จะทำให้ต้านแรงดึงได้น้อยลง สำหรับแผ่นฟิล์มที่เตรียมด้วยกรดอะซิติกและกรดโพรพิโอนิกจะมีการซึมผ่านของน้ำและมีปริมาณสารที่ละลายน้ำได้ต่ำและมีความแข็งแรงต่อแรงดึงสูง ในขณะที่สำหรับแผ่นฟิล์มที่เตรียมด้วยกรดแลคติกจะยืดได้มากและมีปริมาณสารที่ละลายน้ำได้สูงแต่มีความแข็งแรงต่อแรงดึงน้อยที่สุด (Kim, KM., et al., 2006)
มีรายงานว่าไคโตแซนที่แยกจากเปลือกแข็งของสัตว์น้ำ (crawfish) ด้วยกรรมวิธีที่แตกต่างกันจะมีคุณสมบัติที่ไม่เหมือนกันทั้งขนาดน้ำหนักโมเลกุล ความหนืด เปอร์เซ็นต์ของการลดหมู่แอซิติล (%deacetylation) และปริมาณความชื้น จึงสามารถพัฒนาเป็นฟิล์มชนิดต่างๆที่มีคุณสมบัติแตกต่างกัน โดยศึกษาพฤติกรรมในการดูดซับความชื้นของไคโตแซนฟิล์มที่เตรียมจากเปลือกของสัตว์น้ำด้วยกรรมวิธีต่างกันและใช้ตัวทำละลายชนิดต่างๆ และพบว่าการใช้กรดอะซิติกหรือกรดฟอร์มิกเป็นตัวทำละลายจะได้แผ่นฟิล์มไคโตแซนที่มีความยืดหยุ่นและโปร่งใสซึ่งเหมาะแก่การใช้เป็นบรรจุภัณฑ์ ส่วนแผ่นฟิล์มไคโตแซนที่เตรียมด้วยกรดแลคติกหรือกรดมาลิกจะซับน้ำได้ดี (hydrophilic) และกลายเป็นก้อนเหนียวจึงไม่เหมาะสำหรับทำเป็นบรรจุภัณฑ์ และแผ่นฟิล์มไคโตแซนที่เตรียมโดยกรดอะซิติกดูดซับความชื้นได้น้อยกว่าชนิดที่เตรียมจากกรดฟอร์มิก คุณสมบัติในการดูดซับความชื้นของแผ่นฟิล์มมีความสำคัญต่อคุณภาพและการนำมาใช้ในสภาวะที่มีความชื้น กรรมวิธีที่ใช้ในการสกัดแยกไคโตซานจากวัตถุดิบที่ใช้ในการผลิตและชนิดของตัวทำละลายจึงเป็นปัจจัยที่สำคัญในการผลิตแผ่นฟิล์มไคโตแซนที่ดูดซับความชื้นน้อยลง ผลจากการวิจัยต่างๆเหล่านี้จะเป็นแนวทางในการผลิตแผ่นฟิล์มไคโตแซนที่เหมาะกับการใช้ประโยชน์ (Nadarajah, K., et al., 2006)
4. น้ำหนักโมเลกุล ความหนืดและความสามารถในการละลาย (Molecular weight, viscosity, solubility) ไคโตแซนที่ผลิตขึ้นมีหลากหลายชนิดซึ่งจะมีน้ำหนักโมเลกุลและระดับการกำจัดหมู่แอซิติลที่แตกต่างกันออกไป ส่งผลให้สารละลายไคโตแซนมีความหนืดและคุณสมบัติอื่นๆ ที่ต่างกันไปด้วย ไคโตแซนไม่สามารถละลายน้ำแต่ละลายได้ในกรดอินทรีย์ ไคโตแซนเมื่อผ่านปฏิกิริยาการสลายตัวด้วยน้ำ (hydrolysis) จะอยู่ในรูปที่มีน้ำหนักโมเลกุลเล็กลงและในรูปของโอลิโกแซ็กคาไรด์ (oligosaccharide) ที่สามารถละลายน้ำได้และยังคงมีฤทธิ์ยับยั้งการเจริญของเชื้อแบคทีเรียและยีสต์หลายชนิด (Tsai, GJ., Zhang, SL., and Shieh, PL., 2004) สารละลายที่เตรียมจากไคโตแซนที่มีน้ำหนักโมเลกุลสูงจะมีความหนืดมากและไม่สามารถนำไปใช้ประโยชน์ได้หลากหลาย จึงมีการนำไคโตแซนมาย่อยสลายด้วยกรรมวิธีทางเคมีฟิสิกส์หรือใช้เอนไซม์เพื่อตัดสายพอลิเมอร์ให้สั้นลงซึ่งทำให้มีน้ำหนักโมเลกุลเล็กลง จึงเพิ่มประสิทธิภาพในการละลายและถูกดูดซึมได้ดีขึ้นตลอดจนเพิ่มคุณสมบัติอื่นๆ เช่น การยับยั้งการเจริญของแบคทีเรียและเชื้อรา ความสามารถในการต่อต้านเชื้อโรคต่างๆ ต้านมะเร็งและเพิ่มภูมิคุ้มกันโรค (Harish Prashanth, KV. and Tharanathan, RN., 2007; No, HK., et al., 2007)
แหล่งวัตถุดิบในธรรมชาติของไคตินและไคโตแซน (Nature source of chitin and chitosan)
ไคตินและไคโตแซนมักพบอยู่ร่วมกันในธรรมชาติและสามารถผลิตได้จากแหล่งวัตถุดิบจากธรรมชาติ โดยเฉพาะจากเปลือกแข็งของสัตว์น้ำที่ในปีหนึ่งๆ มีเหลือทิ้งอยู่เป็นจำนวนมาก นอกจากนี้ยังพบไคตินและไคโตแซนได้ในสิ่งมีชีวิตชั้นต่ำจำพวกเห็ดรา (fungi) (Synowiecki, J. and Al-Khateeb, NA., 2003)
1. แหล่งสัตว์น้ำที่มีเปลือกแข็ง (Shellfish) เปลือกแข็งของสัตว์น้ำ เช่น กุ้ง ปู ตัวเคย (krill) หอยและแกนปลาหมึก เป็นแหล่งวัตถุดิบในการผลิตไคตินและไคโตแซน ในปัจจุบันสารไคตินที่ใช้ในอุตสาหกรรมผลิตมาจากเปลือกแข็งที่เหลือทิ้งของสัตว์จำพวกกุ้งและปู (crustaceans) เป็นหลัก โดยทั่วไปสัตว์จำพวกนี้มีสารไคตินเป็นองค์ประกอบอยู่ ตั้งแต่ 2-12% ของมวลร่างกายทั้งหมด ปริมาณดังกล่าวขึ้นอยู่กับสภาวะของการลอกเปลือกในขบวนการผลิต ภาวะทางโภชนาการและระยะการเจริญพันธุ์ของสัตว์น้ำ องค์ประกอบหลักในเปลือกแข็งของสัตว์จำพวกกุ้งและปูประกอบด้วยโปรตีน (30-40%) เกลือแร่ (30-50%) และไคติน (13-42%) เกลือแร่ที่พบส่วนใหญ่เป็นพวกเกลือฟอสเฟต (phosphate) และคาร์บอเนต (carbonate) ของแคลเซียมและแมกนีเซียม นอกจากนี้ยังมีไขมันและสารแคโรทีนอยด์ (carotenoids) ในปริมาณเล็กน้อย ปริมาณไคตินจากเปลือกแข็งของปู (13-26% ของน้ำหนักแห้ง) ต่ำกว่าของกุ้ง(14-42% ของน้ำหนักแห้ง) และของตัวเคย (34-49% ของน้ำหนักแห้ง) สำหรับเปลือกหอยกาบ (clam) และหอยนางรม (oyster) มีปริมาณเกลือแร่ต่างๆสูงถึง 90% ของน้ำหนักแห้ง จึงมีปริมาณไคตินน้อย (Synowiecki, J. and Al-Khateeb, NA., 2003)
2. แหล่งจุลินทรีย์ (Microbial sources) พวกเห็ดรา (fungi) หลายชนิดที่สามารถนำมาสกัดไคตินได้ เช่น กลุ่ม Allomyces, Aspergillus, Penicillium, Fusarium, Mucor, Rhisopus, Choanephora, Tamnidium, Zygorrhynchus และ Phy-comyces ซึ่งมีปริมาณไคตินที่แตกต่างกันขึ้นอยู่กับชนิดของรา นอกจากไคตินแล้วยังพบไคโตแซนในผนังเซลล์ของเชื้อราเช่นกัน แม้ปัจจุบันนี้ในทางปฏิบัติยังไม่มีการนำมาใช้เป็นแหล่งผลิตหลักของไคตินและไคโตแซน แต่วิธีการที่จะนำมาใช้ในการผลิตไคตินและไคโตแซนได้มีการศึกษาไว้อย่างละเอียด การผลิตไคตินและไคโตแซนจากเชื้อรามีข้อดีเนื่องจากเชื้อราเหล่านี้มีอยู่แพร่หลาย เจริญเติบโตเร็ว และค่าใช้จ่ายในการเพาะเลี้ยงไม่แพง ยิ่งไปกว่านั้นคือเชื้อราไม่มีเกลือแคลเซียมคาร์บอเนต (calcium carbonate) และเกลือแร่อื่นๆ มาก จึงช่วยประหยัดค่าใช้จ่ายที่ต้องใช้ไปในการทำปฏิกิริยากับกรดดังเช่นที่ใช้ในกระบวนการผลิตจากเปลือกแข็งของสัตว์น้ำ นอกจากนี้สามารถปรับปริมาณการผลิตให้เหมาะสมได้อย่างมีประสิทธิภาพด้วยการควบคุมสภาวะของการหมักเชื้อราและกระบวนการผลิต ตลอดจนการใช้เทคนิคการดัดแปลงพันธุกรรม (genetic manipulation) ปริมาณของไคตินและไคโตแซนที่เคยมีรายงานอยู่ที่ 2-60% ของน้ำหนักผนังเซลล์แห้ง การนำเชื้อรามาใช้จำเป็นต้องจัดองค์ประกอบของอาหารในการเพาะเลี้ยงและเวลาที่เหมาะสม รวมทั้งสภาวะอื่นๆ ที่มีอิทธิพลต่อปริมาณของไคติน ไคโตแซนและโปรตีน (Synowiecki, J. and Al-Khateeb, NA., 2003)
การผลิตไคตินและไคโตแซน (Production of chitin and chitosan)
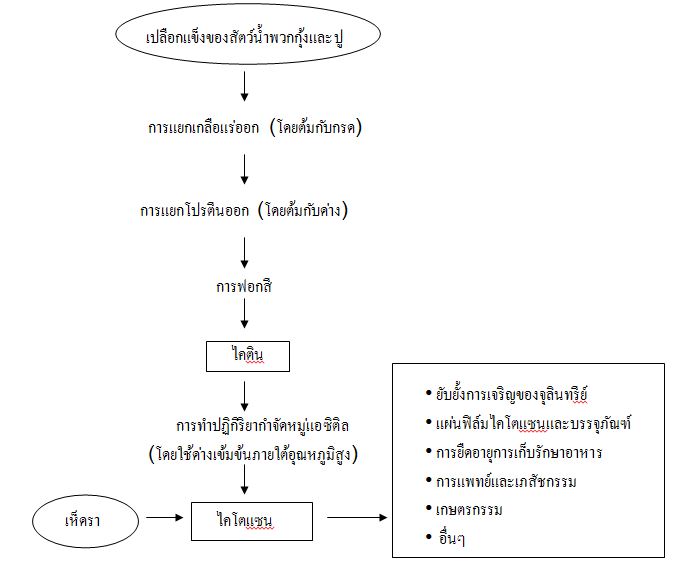
ไคตินและไคโตแซนเป็นสารพอลิแซ็กคาไรด์ที่ผลิตได้จากแหล่งต่างๆ เช่น สัตว์จำพวกกุ้งและปู (crustacean) หอย (mollusks) แมลง สาหร่าย พวกเห็ดราและยีสต์ (รูปที่ 2) ในปัจจุบันแหล่งผลิตไคตินและ ไคโตแซนที่สำคัญคือ เปลือกแข็งของสัตว์จำพวกกุ้งและปู (Synowiecki, J. and Al-Khateeb, NA., 2003) โดยมีกระบวนการผลิตดังนี้
รูปที่ 2 กระบวนการผลิตไคตินและไคโตแซน
1.การผลิตไคติน ประกอบด้วยกระบวนการกำจัดเกลือแร่ (demineralization) กระบวนการกำจัดโปรตีน (deproteinization) และกระบวนการกำจัดหรือฟอกสี (decolourization หรือ bleaching) ซึ่ง 2 กระบวนการแรกสามารถสลับลำดับการทำก่อนหรือหลังได้ ขึ้นอยู่กับการนำไคตินไปใช้ประโยชน์และวิธีการแยกโปรตีนและสารคาโรทีนอยด์ (carotenoids and protein recovery) โดยกระบวนการผลิตไคตินมีรายละเอียดดังนี้
A. กระบวนการกำจัดเกลือแร่ (Demineralization) เป็นขั้นตอนการสกัดเปลือกแข็งโดยการนำวัตถุดิบมาทำปฏิกิริยากับกรดซึ่งโดยทั่วไปใช้กรดไฮโดรคลอริก (hydrochloric acid) เจือจาง (1-8 %) เป็นเวลา 1-3 ชั่วโมงที่อุณหภูมิห้อง นอกจากนี้สามารถใช้กรดฟอร์มิก (formic acid, 90%), กรดไฮโดรคลอริก (ที่ความเข้มข้น 22%, 37%, หรือ 6N ) กรดอะซิติก (acetic acid) หรือ กรดซัลฟูริกหรือกรดกำมะถัน (sulfuric acid) ในสภาวะต่างๆ ที่เหมาะสมทำให้เกลือแร่ถูกกำจัดออกไป การกำจัดเกลือแร่จะทำได้สมบูรณ์เมื่อปริมาณของกรดสูงกว่าเกลือแร่ การทำปฏิกิริยาเป็นเวลานาน (ถึง 24 ชั่วโมง) ทำให้ไคตินแตกสลายได้
B. กระบวนการกำจัดโปรตีน (Deproteinization) เป็นขั้นตอนการแยกโปรตีนออก โดยการทำปฏิกิริยากับด่าง เช่น สารละลายโซเดียมไฮดรอกไซด์ (sodium hydroxide) หรือโพแทสเซียมไฮดรอกไซด์(potassium hydroxide) ประสิทธิภาพในการกำจัดโปรตีนด้วยด่างขึ้นกับอุณหภูมิในการทำปฎิกิริยา ความเข้มข้นของสารละลายด่างและอัตราส่วนระหว่างสารละลายด่างต่อปริมาณของเปลือกแข็ง โดยทั่วไปจะใช้สารละลายโซเดียมไฮดรอกไซด์เจือจางที่ความเข้มข้นตั้งแต่ 1-10% ในการทำปฎิกิริยากับเปลือกแข็งของสัตว์จำพวกกุ้งและปูที่อุณหภูมิสูง (65 -100 องศาเซลเซียส) นอกจากนี้ยังสามารถกำจัดโปรตีนจากเปลือกกุ้งและปูโดยการทำปฏิกิริยาที่อุณหภูมิ 90 องศาเซลเซียสและใช้อัตราส่วนของเปลือกต่อด่างเป็น 1:2 (w/v) โดยใช้สารละลายโพแทสเซียมไฮดรอกไซด์ที่ความเข้มข้นตั้งแต่ 1% หรือ 2% ตามลำดับ และปรกติใช้เวลาในการทำปฏิกิริยา 0.5 ถึง 6 ชั่วโมง การทำปฏิกิริยาในด่างเป็นเวลานานสามารถทำให้เกิดการสลายของสายพอลิเมอร์ (depolymerization) และหมู่แอซิติลถูกกำจัด อีกทางเลือกหนึ่งของวิธีการกำจัดโปรตีนคือ การใช้เอนไซม์ (enzymatic deproteinization) โปรตีนที่แยกด้วยวิธีการนี้จะมีคุณค่ามากกว่าในการนำไปใช้เป็นอาหารสัตว์หรือเป็นองค์ประกอบในอาหาร อย่างไรก็ตามการใช้เอนไซม์ไม่อาจรับรองได้ว่าจะสามารถกำจัดโปรตีนได้อย่างสมบูรณ์ เนื่องจากขึ้นอยู่กับประสิทธิภาพในการกำจัดโปรตีนของเอ็นไซม์และสภาวะในการทำปฏิกิริยา
C. กระบวนการกำจัดหรือฟอกสี (decolourization หรือ bleaching) สารสี (pigment) ในไคตินสามารถกำจัดได้โดยการสกัดด้วยอะซิโตน (acetone) คลอโรฟอร์ม (chloroform) เอธิลอะซิเตต (ethyl acetate) หรือ สารผสมระหว่างเอทานอลและอีเทอร์ (ethanol and ether mixture) และโดยปรกติทำการฟอกสีด้วยสารละลายโซเดียมไฮโปคลอไรท์ (NaOCl) หรือ ไฮโดรเจนเปอร์ออกไซด์ (H2O2)
2. การผลิตไคโตแซน โดยทั่วไปแล้วจะได้ไคโตแซนจากปฏิกิริยาการกำจัดหมู่แอซิติลของไคตินหรือที่เรียกว่า ปฏิกิริยา deacetylation ทำให้เอน-แอซิติลกลูโคซามีนซึ่งเป็นโมเลกุลเดี่ยวของไคตินถูกเปลี่ยนเป็นกลูโคซามีน ดังนั้นจากไคตินจึงเปลี่ยนเป็นไคโตแซน โดยทำปฏิกิริยากับสารละลายโซเดียมไฮดรอกไซด์ (sodium hydroxide) หรือโพแทสเซียมไฮดรอกไซด์ (potassium hydroxide) เข้มข้น (30-60% w/v) ที่อุณหภูมิตั้งแต่ 80-140 องศาเซลเซียส เป็นเวลานานถึง 10 ชั่วโมง แล้วแต่กรรมวิธีที่ใช้ อย่างไรก็ตามควรที่จะต้องควบคุมความเข้มข้นของสารละลายด่าง เวลาและอุณหภูมิในกระบวนการผลิตอย่างเคร่งครัดเนื่องจากมีอิทธิพลต่อระดับการกำจัดหมู่อะซิทิล น้ำหนักโมเลกุลและการจัดเรียงของหน่วยที่ถูกกำจัดหมู่แอซิติล (deacetylated unit) ในสายพอลิแซ็กคาไรด์ ซึ่งจากคุณสมบัติเหล่านี้ทำให้สามารถใช้ประโยชน์จากไคโตแซนได้มากมาย การเตรียมไคโตแซนโดยใช้โซเดียมไฮดรอกไซด์ที่ความเข้มข้นปานกลาง ณ อุณหภูมิค่อนข้างต่ำและใช้เวลานานทำให้เกิดการจัดเรียงของหน่วยที่ถูกกำจัดหมู่อะซิทิลอย่างไม่เจาะจงในโมเลกุลของไคโตแซนและช่วยลดการเกาะเป็นก้อน (aggregates) รวมทั้งการเกิดโครงสร้างอื่นๆ ส่วนการใช้อุณหภูมิสูงทำให้ระดับการกำจัดหมู่แอซิติลเพิ่มขึ้นแต่ก็ทำให้ขนาดโมเลกุลเล็กลงด้วย การทำปฏิกิริยากับด่างเป็นเวลานานไม่ทำให้การกำจัดหมู่อะซิทิลของไคตินเพิ่มขึ้นอย่างมีนัยสำคัญและไม่มีประโยชน์เนื่องจากทำให้สายพอลิเมอร์เกิดการแตกสลาย นอกจากนี้กระบวนการกำจัดโปรตีนก็มีผลต่อน้ำหนักโมเลกุลของไคโตแซนด้วยเช่นกัน และการมีออกซิเจนในระหว่างการทำปฏิกิริยาการกำจัดหมู่แอซิติลของไคติน จะมีผลต่อการแตกสลายของสายพอลิแซ็กคาไรด์จึงลดความหนืดและน้ำหนักโมเลกุลของผลิตภัณฑ์ที่ได้ลง
การเตรียมไคโตแซนที่มีระดับการกำจัดหมู่แอซิติลสูงกว่า 90% โดยไม่ให้เกิดการสลายตัวของโมเลกุลพอลิแซ็กคาไรด์นั้นเป็นสิ่งที่ทำได้ยาก แต่การลดระยะเวลาในการทำปฏิกิริยากับด่างลงโดยแยกกระบวนการกำจัดหมู่แอซิติลเป็นขั้นตอนย่อยๆจะช่วยให้น้ำหนักโมเลกุลของผลิตภัณฑ์เกิดการเปลี่ยนแปลงน้อยลง ซึ่งวิธีการหนึ่งที่สามารถกำจัดหมู่อะซิทิลได้เกือบสมบูรณ์คือการทำปฏิกิริยาของสารไคตินในสารละลายโซเดียมไฮดรอกไซด์ (ความเข้มข้น 50%) ที่อุณหภูมิ 4 องศาเซลเซียส เป็นเวลา 24 ชั่วโมงก่อน แล้วตามด้วยขั้นตอนการแยกและผสมกับสารละลายโซเดียมไฮดรอกไซด์ (ความเข้มข้น 10%) และให้ความร้อนสูงถึงอุณหภูมิ 230 องศาเซลเซียสและการลดความดัน (decompression) ของส่วนผสมลงอย่างรวดเร็ว
การผลิตไคโตแซนจากไคตินโดยใช้ด่างมักจะได้ผลิตภัณฑ์ที่มีน้ำหนักโมเลกุลและระดับการกำจัดหมู่แอซิติลที่แตกต่างและหลากหลาย ซึ่งการเปลี่ยนแปลงของระดับการกำจัดหมู่แอซิติลและน้ำหนักโมเลกุลที่เป็นผลมาจากสภาวะของกระบวนการผลิต ย่อมจะมีอิทธิพลต่อคุณสมบัติที่สำคัญในการนำไปใช้ประโยชน์ต่างๆ เช่น การละลายในกรด ความหนืดของสารละลายที่ได้ ตลอดจนฤทธิ์ทางชีวภาพ (biological activity) ของไคโตแซน จึงจำเป็นต้องพัฒนาวิธีการผลิตไคตินและไคโตแซนที่เป็นมาตรฐาน นอกจากนี้การใช้สารละลายด่างเข้มข้นจำนวนมากย่อมส่งผลกระทบต่อสิ่งแวดล้อม ดังนั้นอีกทางเลือกของผลิตไคโตแซนแทนวิธีการกำจัดหมู่อะซิทิลโดยการใช้ด่างคือ การแยกไคโตแซนที่เกิดขึ้นและมีอยู่แล้วตามธรรมชาติจากสิ่งมีชีวิตชั้นต่ำพวกเห็ดรา (fungal) หรือโดยการใช้เอนไซม์ chitin deacetylase
เส้นใยของพวกเห็ดราที่ผ่านการขจัดโปรตีนออกแล้ว สามารถนำมาสกัดไคโตแซนได้ด้วยกรดอะซิติกเจือจางและเติมสารละลายโซเดียมไฮดรอกไซด์เพื่อทำให้ตกตะกอน อีกวิธีหนึ่งคือการต้มเส้นใยของพวกเห็ดรากับสารละลายโซเดียมไฮดรอกไซด์เข้มข้น ซึ่งวิธีนี้สามารถกำจัดโปรตีนและลดหมู่แอซิติลของไคตินที่มีอยู่ในเซลล์ได้ด้วย จึงได้ปริมาณไคโตแซนเพิ่มขึ้นจากไคติน แต่อย่างไรก็ตามการใช้สารละลายด่างเข้มข้นทำให้เกิดการกำจัดหมู่แอซิติลและการสลายตัวของไคโตแซนอย่างมากเกินกว่าจะควบคุมได้ นอกจากนี้ผลผลิตไคโตแซนที่ได้จะมีการปนเปื้อนของสารกลูแคน (glucan) และไม่มีประโยชน์ต่อการนำไปใช้งาน ดังนั้นจึงควรเลือกใช้เห็ดราชนิดที่มีปริมาณไคโตแซนสูงเพื่อจะได้ตัดขั้นตอนการใช้ด่างในการกำจัดหมู่แอซิติลของไคติน
สำหรับการใช้เอนไซม์ไคตินดีอะเซทิเลสในการผลิตไคโตแซน หรือ โอลิโกเมอร์ของไคโตแซน (oligomers) ได้มีการศึกษาอย่างกว้างขวาง ถึงแม้ว่าไคติน (ซึ่งเป็นผลึกที่ไม่ละลายในน้ำ) จะต้านทาน (resistant) ต่อเอนไซม์ในการกำจัดหมู่แอซิติล แต่ไคตินที่ผ่านกระบวนทางเคมีเพื่อกำจัดหมู่แอซิติลไปบางส่วนแล้วสามารถนำไปกำจัดหมู่แอซิติลด้วยเอนไซม์ต่อไปได้ กระบวนทางเอนไซม์นี้จะมีประสิทธิภาพในกำจัดหมู่แอซิติลสำหรับโอลิโกเมอร์ของไคติน (oligomers) มากกว่า เพราะละลายน้ำได้และเข้าถึงเอนไซม์ได้ดีกว่า ปฏิกิริยาการลดหมู่แอซิติลด้วยเอนไซม์นี้จะได้โอลิโกเมอร์ของไคโตแซน (chitosan oligomers) ที่มีน้ำหนักโมเลกุลและปริมาณของ N-acetyl residues อยู่ในช่วงที่กำหนดได้แน่นอนซึ่งตรงข้ามกับการใช้กระบวนการทางเคมี ซึ่งสภาวะของวิธีการผลิตที่หลากหลายส่งผลให้ได้ไคโตแซนที่มีความแตกต่างกันในด้านต่างๆซึ่งได้แก่ระดับการกำจัดหมู่แอซิติล การกระจายตัวของหมู่แอซิติล ความยาวของสายพอลิเมอร์ โครงสร้างและน้ำหนักโมเลกุล ซึ่งสิ่งเหล่านี้จะมีอิทธิพลต่อการละลาย การยับยั้งการเจริญเติบโตของจุลินทรีย์ และคุณสมบัติอื่นๆ
ประโยชน์ของไคโตแซนในการยืดอายุอาหารและเครื่องดื่ม
1. บรรจุภัณฑ์สำหรับอาหาร (Food
packaging) จากคุณสมบัติที่หลากหลายและมีประโยชน์ของไคโตแซน โดยเฉพาะอย่างยิ่งคุณสมบัติในการทำให้เป็นแผ่นฟิล์มที่ป้องกันการซึมผ่านของน้ำและก๊าซต่างๆ และความสามารถในการยับยั้งการเจริญเติบโตของจุลินทรีย์ ประกอบกับเป็นสารที่มาจากธรรมชาติ ไม่ก่อภูมิแพ้และปลอดภัยต่อสุขภาพและสิ่งแวดล้อมตลอดจนสามารถเติมสารที่มีประโยชน์ เช่น วิตามินและเกลือแร่ต่างๆลงในแผ่นฟิล์มได้ ไคโตแซนจึงได้รับความสนใจอย่างมากในการนำมาใช้เป็นวัตถุดิบในการบรรจุหีบห่อหรือเคลือบผลิตภัณฑ์อาหารที่เกิดการเน่าเสียได้ง่าย เพื่อยืดอายุการเก็บรักษาอาหารและเครื่องดื่มต่างๆ เช่น ผัก ผลไม้ เนยแข็ง และขนมปัง ซึ่งมีรายงานการศึกษาวิจัยมากมายที่แสดงให้เห็นถึงประสิทธิภาพดังกล่าวนี้ (No, HK., et al., 2007)
มีงานวิจัยจำนวนไม่น้อยที่ศึกษาการผลิตบรรจุภัณฑ์ที่มีคุณสมบัติในการต้านเชื้อจุลินทรีย์โดยการผสมสารถนอมอาหาร (preservatives) ต่างๆ ลงไป เช่นเดียวกับการศึกษาบรรจุภัณฑ์ที่สามารถยับยั้งการเจริญของแบคทีเรียและยีสต์ในนมและน้ำส้มคั้น ตามลำดับ โดยทดลองกับแผ่นกระดาษแข็ง (paper board) ที่เคลือบด้วยสารไนซิน (nisin) และ/หรือไคโตแซน และตรวจนับจำนวนเชื้อแบคทีเรียและยีสต์ในน้ำนมและน้ำส้มคั้นที่สัมผัสกับกระดาษที่เคลือบด้วยสารไนซินและ/หรือไคโตแซน พบว่าแผ่นกระดาษที่เคลือบด้วยสารไนซินและ/หรือไคโตแซนมีประสิทธิภาพในการต้านเชื้อจุลินทรีย์โดยสามารถยับยั้งการเจริญของเชื้อจุลินทรีย์ดังกล่าวได้ดีที่อุณหภูมิต่ำ (3 และ 10 องศาเซลเซียส) แต่มีผลเพียงเล็กน้อยที่อุณหภูมิสูงขึ้น (20 องศาเซลเซียส) สำหรับแผ่นกระดาษที่เคลือบด้วยสารไนซินร่วมกับไคโตแซนจะมีฤทธิ์ยับยั้งเชื้อจุลินทรีย์ได้ดีที่สุด (Lee, CH., Park, HJ., and Lee, DS., 2004)
2. ไข่ (Egg) ตามปรกติในระหว่างการเก็บรักษาไข่มักประสบกับปัญหาต่างๆเช่น ไข่มีน้ำหนักลดลง ไข่ขาวเหลว เสื่อมคุณภาพและอาจเน่าเสียอันเนื่องมาจากการสูญเสียก๊าซคาร์บอนไดออกไซด์และความชื้นผ่านออกทางเปลือกไข่และจากการปนเปื้อนของเชื้อจุลินทรีย์ทำให้ไม่สามารถเก็บรักษาให้คงคุณภาพได้นาน จากข้อมูลการศึกษาโดยใช้ไคโตแซน [เดี่ยวๆหรือผสมสารที่ทำให้เกิดความยืดหยุ่น (plasticizer) เช่น กลีเซอรอล] เคลือบผิวของไข่จะช่วยป้องกันไม่ให้ก๊าซและความชื้นจากไข่ขาวผ่านออกทางเปลือกไข่ จึงช่วยรักษาความสดและเก็บได้นานขึ้น (No, HK., et al., 2007) จากการวิจัยโดย Caner, C and Cansiz, O. (2007) พบว่าไข่ที่เคลือบผิวด้วยไคโตแซนมีคุณภาพของไข่แดงและไข่ขาวที่ดีกว่าและมีการสูญเสียน้ำหนักน้อยกว่าเมื่อเทียบกับไข่ที่ไม่ได้เคลือบ รวมทั้งปริมาณเกลือแร่ (แคลเซียม เหล็กและแมกนีเซียม) ในไข่แดงยังคงอยู่ในระดับที่มีคุณค่าทางโภชนาการหลังการเก็บรักษานาน 4 สัปดาห์ และมีรายงานเพิ่มเติมว่าการเคลือบผิวไข่ด้วยไคโตแซนยังช่วยรักษาคุณภาพของไข่ขาวได้ดีกว่าไข่ที่ไม่ได้เคลือบเมื่อเปรียบเทียบจากความหนืด ค่าความเป็นกรด-ด่าง (pH) และสีของไข่ขาว นอกจากนี้ไคโตแซนช่วยให้เปลือกไข่มีความแข็งแรงขึ้นโดยไม่ทำให้ลักษณะภายนอกของไข่เปลี่ยนแปลงและเป็นที่ยอมรับของผู้บริโภค การผลิตไคโตแซนประกอบด้วยขั้นตอนการกำจัดโปรตีน การกำจัดเกลือแร่ การกำจัดสี และการกำจัดหมู่แอซิติล ซึ่งหากสามารถตัดลดขั้นตอนหรือระยะเวลาในการทำปฏิกิริยาลงจะช่วยลดค่าใช้จ่าย ต่างๆ ลงได้มาก ซึ่งไคโตแซนที่ได้จากกระบวนการผลิตที่มีการตัดทอนให้ง่ายขึ้นนี้ สามารถนำมาใช้เพื่อเคลือบผิวของไข่ได้เพราะไม่จำเป็นต้องใช้ไคโตแซนที่บริสุทธิ์ และพบว่ามีประสิทธิภาพในการรักษาคุณภาพภายในของไข่ได้เช่นกัน
3. ขนมปังและเบอร์เกอร์ (Bread and burger) ขนมปังเป็นอาหารที่มีอายุการเก็บรักษาที่จำกัดเพราะจะเกิดการเสื่อมสภาพ มีกลิ่นอับและบูดเสียจากการเจริญของเชื้อจุลินทรีย์ จากผลการศึกษาวิจัยที่รวบรวมโดย No, HK., et al. (2007) แสดงให้เห็นว่าขนมปังที่เคลือบด้วยไคโตแซน (1-2%) ที่มีน้ำหนักโมเลกุลตั้งแต่ 2-493 kDa สามารถเก็บรักษาได้นานกว่า มีการเสื่อมสภาพ การสูญเสียน้ำและความแข็งของขนมปังน้อยกว่ารวมทั้งพบว่ามีปริมาณเชื้อราและจุลินทรีย์อื่นๆ ต่ำกว่าเมื่อเปรียบเทียบกับขนมปังที่ไม่ได้เคลือบ ขนมปังที่เคลือบหรือเติมไคโตแซนสามารถคงคุณภาพและเก็บได้นานนั้นเป็นผลมาจากคุณสมบัติของไคโตแซนในการป้องกันการสูญเสียความชื้นและความสามารถในการชะลอการเสื่อมสภาพและยับยั้งการเจริญของเชื้อจุลินทรีย์น้ำหนักโมเลกุลและความเข้มข้นของไคโตแซนที่ใช้ในขนมปังมีผลต่อการยืดอายุในการเก็บรักษา ไคโตแซนที่มีน้ำหนักโมเลกุลสูง (30 และ 120 kDa) จะช่วยยืดเวลาการเก็บรักษาได้นานกว่าชนิดที่มีน้ำหนักโมเลกุลต่ำกว่า (1 และ 5 kDa) และการเพิ่มความเข้มข้นทำให้ยับยั้งการเจริญของเชื้อแบคที่เรียได้ดีขึ้นด้วย
ไคโตแซนเป็นสารอีกชนิดหนึ่งที่มีการนำมาใช้ในเบอร์เกอร์เนื้อ (beef burger) เพื่อรักษาคุณภาพของเนื้อสัตว์ ลดการเกิดกลิ่นหืดและคงสภาพสีของเนื้อสัตว์ภายหลังการแช่แข็งเป็นเวลานาน มีงานวิจัยที่ใช้ไคโตแซนเดี่ยวๆ หรือไคโตแซนผสมรวมกับสารสกัดโรสแมรี่ (rosemary extract) หรือสารอัลฟาโทโคเฟอรอล (-tocopherol) เติมลงในเบอร์เกอร์เนื้อ พบว่า ช่วยชะลอการหืนหรือการเกิดปฏิกิริยาออกซิเดชันของไขมัน (lipid peroxidation) และรักษาสีแดงของเนื้อสัตว์ไว้ได้นานขึ้นตลอดระยะเวลาในการเก็บรักษาที่อุณหภูมิ -18 องศาเซสเซียส นาน 180 วัน ซึ่งการใช้ไคโตแซนร่วมกับสารสกัดจากโรสแมรี่ให้ผลดีที่สุด (Georgantelis, D., et al., 2007)
4. ผลไม้ (Fruit) การเคลือบผลไม้เป็นวิธีหนึ่งที่มีประสิทธิภาพในการเก็บรักษาผลไม้หลังการเก็บเกี่ยวที่มักพบปัญหาการเน่าเสียจากเชื้อราหรือมีการเปลี่ยนแปลงของลักษณะทั้งภายในและภายนอก การเคลือบผิวผลไม้ช่วยลดอัตราการซึมผ่านของน้ำและก๊าซต่างๆ เช่น คาร์บอนไดออกไซด์ ออกซิเจนและเอทิลีน(ethylene) ชะลอการเจริญของจุลินทรีย์และการเปลี่ยนสีของผลไม้ จึงช่วยชะลอการสุกของผลไม้และยืดอายุการเก็บรักษาผลไม้ได้นานขึ้นรวมทั้งรักษาความสดและทำให้เนื้อผลไม้มีคุณภาพดีขึ้นด้วย (No, HK., et al., 2007)
สตรอเบอรี่เป็นผลไม้ที่ติดเชื้อราและเน่าเสียง่ายและมีผิวภายนอกบอบบางจึงง่ายต่อการถูกทำลาย การเคลือบผลสตรอเบอรี่สดด้วยไคโตแซนพบว่าสามารถชะลอการเน่าเสียของผลสตรอเบอรี่ ทำให้ผลสตรอเบอรี่มีความเป็นกรดสูงขึ้น มีการสังเคราะห์สารแอนโทรไซยานิน (anthrocyanin) ช้าลง ผลมีเนื้อแน่นขึ้นและไม่มีรสชาติที่ผิดปรกติไปหลังการเก็บรักษาแต่อาจมีรสขมฝาดเล็กน้อยในวันแรกที่เคลือบได้ (No, HK., et al., 2007; Devlieghere, F., et al., 2004) เช่นเดียวกับงานวิจัยของ ดนัย บุณยเกียรติ และ พิมพ์ใจ สีหะนาม (2546) พบว่า การเคลือบผิวสตรอเบอรี่ด้วยไคโตแซน (1.5 และ 2.0 %) และเก็บรักษาที่อุณหภูมิ 5 องศาเซลเซียสช่วยคงความสดของผลสตรอเบอรี่ได้ดีกว่าและถูกทำลายโดยเชื้อราน้อยกว่าผลที่ไม่ได้เคลือบผิว รวมทั้งไม่มีผลกระทบต่อสีผิว สีเนื้อ ปริมาณของแข็งที่ละลายน้ำได้ ปริมาณกรดที่ไทเทรตได้และความแน่นของเนื้อผลสตรอเบอรี่ นอกจากนี้การศึกษาในผลไม้อื่นๆ เช่น มะเขือเทศ แอปเปิ้ล กล้วย ผลไม้ตระกูลส้ม และมะม่วง พบว่าให้ผลในทำนองเดียวกัน ผลแอปเปิ้ลที่เคลือบด้วย N,O-carboxymethyl chitosan film สามารถเก็บรักษาในที่เย็นได้นานถึง 6 เดือน การใช้ไคโตแซนความเข้มข้นต่ำ (12.5-125 มิลลิกรัมต่อลิตร) ในผลไม้ตระกูลส้มชนิดหนึ่ง (Clementine mandarin fruit) ในช่วงก่อนและหลังการเก็บเกี่ยว พบว่า ช่วยชะลอการเปลี่ยนสีของเปลือกผลไม้โดยไม่มีผลต่อคุณสมบัติภายใน (ปริมาณของแข็งที่ละลายน้ำได้ในน้ำผลไม้และความเป็นกรด) ของผลไม้ ผลไม้มีเปลือกแน่นและดูดซึมน้ำน้อยลง รวมทั้งลดการเกิดคราบหยดน้ำ (water spot) บนผิวของผลไม้ ซึ่งผู้วิจัยคาดว่าไคโตแซนที่ความเข้มข้นดังกล่าวนี้ไม่น่าจะทำให้เกิดเป็นฟิล์มเคลือบผิวผลไม้แต่จะถูกดูดซึมโดยเซลล์ที่เปลือกเข้าไปข้างในผลไม้และแสดงผลการชะลอการสุกงอมและยับยั้งเชื้อราออกมา (Fornes, F., et al., 2005) นอกจากนี้การเคลือบผิวด้วยไคโตแซนสามารถชะลอการเปลี่ยนเป็นสีน้ำตาลของเปลือกลิ้นจี่ (No, HK., et al., 2007)
การเคลือบผิวสตรอเบอรี่ด้วยไคโตแซน (1%) ไม่ทำให้มีรสฝาด ผลสตรอเบอรี่ที่เคลือบด้วยไคโตแซนในสารละลายกรดแลคติกจะมีผิวเป็นมันเงาขึ้น ต่างจากวิตามินอีที่ทำให้ผลสตรอเบอรี่ที่เคลือบมีความมันเงาลดลง ซึ่งอาจกระทบต่อการยอมรับของผู้บริโภค (Han, C., et al., 2005) ส่วนการทดลองเคลือบผิวสตรอเบอรี่สดด้วยไคโตแซน (2%) ที่ผสมกับสารโพแทสเซียมซอร์เบท (0.3% potassium sorbate) ไม่พบว่าได้ผลดีกว่าไคโตแซนเดี่ยวๆในการยับยั้งการเจริญของเชื้อราเท่านั้นแต่ยังเพิ่มการซึมผ่านของน้ำและอาจทำให้ควบคุมน้ำหนักไม่ได้ นอกจากนี้การเคลือบผิวด้วยไคโตแซนสามารถใช้เป็นตัวกลางในการเติมสารต่างๆ เพื่อเพิ่มคุณค่าทางโภชนาการของผลไม้ เช่น แคลเซียม วิตามินอี และกรดโอลีอิก (oleic acid) ซึ่งการผสมสารเหล่านี้ในแผ่นฟิล์มพบว่านอกจากจะไม่มีผลกระทบในทางลบต่อคุณสมบัติต่างๆ และการยืดอายุการเก็บรักษาอาหารของแผ่นฟิล์มไคโตแซนแล้ว ยังทำให้ฤทธิ์ในการยับยั้งจุลินทรีย์และประสิทธิภาพในการป้องกันความชื้นของแผ่นฟิล์มเพิ่มขึ้น สำหรับปริมาณสารอาหารที่เพิ่มขึ้นน่าจะมาจากการซึมผ่านเข้าไปในระหว่างการแช่ผลไม้ (No, HK., et al., 2007)
5. นม (Milk) มีการศึกษาถึงความเป็นไปได้ที่จะนำไคโตแซนมาใช้เพื่อรักษาคุณภาพและยืดเวลาการเก็บรักษา ซึ่งจากการศึกษาผลของไคโตแซนชนิดที่ละลายน้ำ (water soluble chitosans) ที่มีขนาดโมเลกุลต่างๆ (0.2-3, 3-10 และ 10-30 kDa) พบว่าไคโตแซนมีผลกระทบต่อลักษณะและรสชาติของนม ความหนืดข้น (consistency) ของน้ำนมที่ผสมไคโตแซนจะเพิ่มขึ้นเมื่อน้ำหนักโมเลกุลและความเข้มข้นของไคโตแซนสูงขึ้น (0.5%, 1.0 % และ 1.5 %) นมที่ผสมไคโตแซนที่ความเข้มข้น 0.5% และ 1.0% สามารถนำไปผ่านการฆ่าเชื้อที่อุณหภูมิ 73 องศาเซสเซียส นาน 15 วินาทีได้โดยไม่ทำให้โปรตีนจับตัวเป็นก้อน การเติมไคโคแซนความเข้มข้น 0.5 % ในน้ำนมมีผลกระทบต่อคุณภาพ สี กลิ่น และรสชาติของนม เช่น น้ำนมเปลี่ยนเป็นสีน้ำตาล มีกลิ่นสารเคมีและมีรสฝาดเป็นต้น แต่อย่างไรก็ตามการเติมไคโตแซนไม่ทำให้รสชาติของนมปรุงแต่งรสกาแฟ (coffee-flavored milk) แตกต่างไปจากนมที่ไม่ได้เติมไคโตแซน ทั้งนี้อาจเป็นผลมาจากการถูกกลบเกลื่อนด้วยกลิ่นรสกาแฟ นอกจากนี้ไคโตแซนยังมีผลยับยั้งการเจริญของจุลินทรีย์เมื่อเก็บไว้นาน 15 วันที่อุณหภูมิ 4 และ 10 องศาเซสเซียส และนมที่ผสมไคโตแซนมีค่าความเป็นกรด-ด่าง (pH) สูงกว่านมปรกติ นอกจากนี้งานวิจัยเพิ่มเติมพบว่าไคโตแซนชนิดละลายน้ำได้ (0.03%) มีประสิทธิภาพในการยับยั้งการเจริญของเชื้อจุลินทรีย์และชะลอการบูดเสียของนมปรุงแต่งรสกล้วย (banana-flavored milk) ในระหว่างการเก็บรักษาเป็นเวลา 15 วัน ที่อุณหภูมิ 4 และ 10 องศาเซลเซียสและน้ำนมที่ผสมไคโตแซนดังกล่าวยังคงค่าความเป็นกรด-ด่างไว้สูงกว่านมที่ไม่ได้เติมไคโตแซน (No, HK., et al., 2007)
6. น้ำผลไม้ (Juice) ไคโตแซนได้รับความสนใจนำมาใช้ในกระบวนการผลิตน้ำผลไม้ เนื่องจากมีคุณสมบัติในการจับกับกรดและมีประสิทธิภาพในการช่วยแยกอนุภาคแขวนลอย จึงทำให้น้ำผลไม้มีความใส ไคโตแซนชนิดที่ละลายน้ำได้ช่วยลดความขุ่นของน้ำผลไม้หลายชนิด เช่น แอปเปิ้ล องุ่น มะนาว และส้ม ได้ดีกว่าสารเบนโทไนท์ (bentonite) และเจลาติน (gelatin) ทำให้น้ำผลไม้น่ารับประทาน นอกจากนี้มีรายงานด้วยว่าไคโตแซนที่ผลิตได้จากเห็ดรา (fungal chitosan) มีประสิทธิภาพมากกว่าไคโตแซนที่ผลิตได้จากเปลือกกุ้งในการลดความขุ่นข้นของน้ำแอปเปิ้ล ไคโตแซนยังช่วยควบคุมความเป็นกรดของน้ำผลไม้ รวมทั้งป้องกันการเปลี่ยนเป็นสีน้ำตาลของน้ำผลไม้บางชนิด เช่น แอปเปิ้ลและแพร์ ตลอดจนยับยั้งการเจริญของเชื้อจุลินทรีย์และยีสต์ที่เป็นสาเหตุของการบูดเสียของน้ำผลไม้ (No, HK., et al., 2007)
7. เบียร์ (Beer) การปนเปื้อนของเชื้อแบคทีเรียที่เกิดขึ้นในระหว่างกระบวนการผลิตเป็นสาเหตุสำคัญที่ทำให้เบียร์ขุ่นและกลิ่นรสเปลี่ยนแปลงไม่เป็นที่น่าพอใจ เชื้อแบคทีเรียแกรมลบและเชื้อแบคทีเรียกรดแลคติค (lactic acid bacteria) ที่มักพบร่วมกับยีสต์ที่ใช้ในขั้นตอนการหมักบ่มทำให้เบียร์มีกรดมากเกินไปและมีกลิ่นรสที่ผิดแผกไป นอกจากนี้เครื่องบรรจุเบียร์ลงกระป๋องหรือขวดแก้วยังเป็นแหล่งสะสมของเชื้อแบคทีเรียชนิด Bacillus ssp. ซึ่งความร้อนจากขบวนการฆ่าเชื้อแบบพลาสเจอร์ไรเซชั่น (plasteurization) ไม่สามารถกำจัดเชื้อแบคทีเรียเหล่านี้ได้อย่างมีประสิทธิภาพโดยปราศจากผลกระทบต่อกลิ่นรสของเบียร์และคุณภาพของกระป๋องบรรจุเบียร์ (bottle integrity) นอกจากนี้ยังพบว่า ไคโตแซนสามารถยับยั้งเชื้อ Escherichia coli ในน้ำเบียร์ที่ต้มแล้วแต่ยังไม่ได้หมัก (wort) แสดงให้เห็นว่าไคโตแซนใช้ป้องกันการปนเปื้อนของแบคทีเรียในน้ำเบียร์ระหว่างการเก็บรักษาก่อนนำไปต้ม ไคโตแซนสามารถทนต่อความร้อนโดยยังคงฤทธิ์ในการยับยั้งเชื้อแบคที่เรียได้อยู่แม้ผ่านการต้มมาแล้ว สำหรับเชื้อแบคทีเรียกรดแลคติก (lactic acid bacteria) เช่น Pediococcus sp. ที่มักพบมากับยีสต์ในระหว่างการหมักเบียร์ สามารถยับยั้งได้ด้วยไคโตแซนโดยไม่ทำให้เซลล์ยีสต์ตายและไม่ทำให้ค่าความเป็นกรด-ด่าง ปริมาณเอทานอล รูปลักษณะและกลิ่นรสของเบียร์เปลี่ยนแปลงไป งานวิจัยดังกล่าวยังแสดงให้เห็นว่าไคโตแซนสามารถต้านเชื้อ B. Megaterium ซึ่งเป็นเชื้อที่ทนความร้อนและพบได้ในขั้นตอนการบรรจุเบียร์ และเนื่องจากไคโตแซนเป็นสารที่ทนต่อความร้อนได้ดีจึงสามารถผสมไคโตแซนในเบียร์ก่อนนำไปผ่านการฆ่าเชื้อด้วยวิธีพลาสเจอร์ไรเซชั่นเพื่อลดระยะเวลาและ/หรืออุณหภูมิที่ใช้ในกระบวนการผลิต ซึ่งจะทำให้กลิ่นและรสชาติของเบียร์ไม่เปลี่ยนแปลงมากนักและเป็นการลดความเสี่ยงต่อการแตกของขวดบรรจุเบียร์ นอกจากนี้ไคโตแซนยังช่วยทำให้เบียร์มีความต้านทานต่อเชื้อจุลินทรีย์ (Lactobacillus plantarum หรือ Pediococcus sp. ที่แยกได้จากน้ำเบียร์ที่ต้มแล้วแต่ยังไม่ได้หมัก) ในระหว่างการเก็บรักษา แต่ทว่าเบียร์ที่ผสมไคโตแซนจะมีลักษณะเป็นฝ้า (haze) ซึ่งสามารถขจัดออกได้โดยง่ายด้วยการกรอง ดังนั้นจึงต้องใช้ไคโตแซนในขั้นตอนการผลิตก่อนหน้านี้ ผลงานวิจัยนี้ได้แสดงให้เห็นประสิทธิภาพของไคโตแซนในการยับยั้งเชื้อแบคทีเรียที่อาจปนเปื้อนในระหว่างการผลิตเบียร์และอาจนำไคโตแซนไปใช้เพื่อยืดระยะเวลาในการเก็บรักษาเบียร์หรือใช้ร่วมกับการฆ่าเชื้อด้วยวิธีพลาสเจอร์ไรเซชัน (Galvagno, MA., et al., 2007)
บทสรุป
ไคโตเซนเป็นสารพอลิเมอร์ของคาร์โบไฮเดรตที่ผลิตได้จากไคตินด้วยปฎิกิริยาการกำจัดหมู่แอซิติลของไคติน ไคโตแซนส่วนใหญ่ผลิตมาจากไคตินที่สกัดมาจากเปลือกแข็งของสัตว์น้ำ เช่น ปู และกุ้ง โดยขั้นตอนการผลิตที่สำคัญประกอบด้วยกระบวนการกำจัดโปรตีน การกำจัดเกลือแร่ การฟอกสีและกระบวนการกำจัดหมู่แอซิติล นอกจากนี้อาจพบไคโตแซนที่มีอยู่ตามธรรมชาติในพวกเห็ดราและยีสต์ ไคโตแซนที่ผลิตได้จะมีค่าระดับการกำจัดหมู่อะซิทิลและน้ำหนักโมเลกุลที่แตกต่างกันขึ้นอยู่กับสภาวะของการผลิต ไคโตแซนเป็นสารที่ไม่ละลายน้ำแต่จะละลายได้ดีในกรดอินทรีย์ ค่าระดับการกำจัดหมู่แอซิติลและน้ำหนักโมเลกุลของไคโตแซนมีผลโดยตรงต่อคุณสมบัติในการละลายและความหนืดซึ่งจะส่งผลต่อถึงคุณสมบัติด้านอื่นของไคโตแซนด้วยเช่นกัน คุณสมบัติที่สำคัญของไคโตแซนในการยับยั้งการเจริญของเชื้อจุลินทรีย์ในอาหารหลายชนิด เช่น แบคทีเรีย ราและยีสต์ ตลอดจนตวามสามารถในการนำมาขึ้นรูปเป็นแผ่นฟิล์มหรือใช้เคลือบเป็นเยื่อบางที่สามารถรับประทานได้และมีประสิทธิภาพในการป้องกันการผ่านเข้า-ออกของน้ำหรือความชื้นและก๊าซต่างๆ จึงทำให้ไคโตแซนได้รับความสนใจในการนำมาใช้เป็นวัตถุดิบในการบรรจุหีบห่อหรือผสมลงในอาหารเพื่อช่วยยืดอายูในการเก็บรักษาโดยเฉพาะอาหารที่เน่าเสียได้ง่าย นอกจากนี้การที่ไคโตแซนเป็นสารที่สามารถย่อยสลายได้เองในธรรมชาติและเป็นมิตรต่อสิ่งแวดล้อม ยิ่งดึงดูดให้มีการศึกษาอย่างกว้างขวางในยุคที่มนุษย์เรากำลังให้ความสนใจกับการใช้สารที่ปลอดภัยจากธรรมชาติ และผลจากการวิจัยจำนวนมากก็ได้แสดงให้เห็นว่า ไคโตแซนมีประสิทธิภาพในการถนอมอาหาร และการเคลือบอาหารด้วยไคโตแซนสามารถช่วยรักษาคุณภาพและยืดระยะเวลาในการเก็บรักษาอาหารได้หลายชนิด รวมทั้งการที่ไคโตแซนได้รับการรับรองให้เป็นสารเติมแต่งอาหาร (food additive) ในประเทศเกาหลีและญี่ปุ่นเป็นที่เรียบร้อยแล้วตั้งแต่ปี ค.ศ. 1995 จึงน่าที่จะมีการนำไคโตแซนมาใช้ประโยชน์ทางอาหารเพิ่มมากขึ้นอย่างแน่นอนในอนาคต อย่างไรก็ตามประสิทธิภาพในการถนอมอาหารของไคโตแซนขึ้นอยู่กับปัจจัยหลายอย่าง เช่น ชนิดและสภาพของอาหาร อุณหภูมิที่ใช้เก็บรักษาอาหารตลอดจนชนิดของจุลินทรีย์ จึงอาจจำเป็นต้องใช้ไคโตแซนร่วมกับวิธีการถนอมอาหารแบบอื่น การใช้ไคโตแซนร่วมอาจช่วยลดปริมาณการใช้สารถนอมอาหารอื่นหรือสามารถลดอุณหภูมิที่ใช้ในกระบวนการผลิตทำให้อาหารไม่ต้องผ่านกระบวนการผลิตมากเกินไป จึงช่วยลดการสูญเสียรสชาติและคุณค่าของอาหาร พร้อมกันนี้การศึกษาวิจัยเพิ่มเติมเป็นสิ่งที่จำเป็นเพื่อให้สามารถใช้ประโยชน์จากไคโตแซนได้อย่างมีประสิทธิภาพมากยิ่งขึ้น เช่น การพัฒนาวิธีการผลิตไคโตแซนให้มีคุณสมบัติทางเคมีฟิสิกส์คงที่และสม่ำเสมอ การศึกษาคุณสมบัติทางเคมีฟิสิกส์และประโยชน์ด้านต่างๆ ของไคโตแซนและอนุพันธ์ การปรับปรุงวิธีการผลิตให้ง่ายและประหยัดขึ้น การศึกษาชนิดของไคโตแซนที่มีความเหมาะสม (ในเชิงของขนาดโมเลกุลและค่าของระดับการกำจัดหมู่แอซิติล)ในการนำมาใช้ในอาหาร การปรับปรุงเพื่อกลบรสขมและฝาดของไคโตแซนที่ใช้ถนอมอาหาร การพัฒนาแผ่นฟิล์มไคโตแซนให้มีความทนทานต่อความชื้น การศึกษาผลของกรรมวิธีการผลิต ตัวทำละลายที่ใช้ในการทำแผ่นฟิล์ม และปริมาณสารที่ช่วยให้ความยืดหยุ่นต่อพฤติกรรมการดูดซับของแผ่นฟิล์ม ตลอดจนการทดลองศึกษาในระดับกว้างหรือในเชิงพาณิชย์เพื่อจะได้ข้อมูลในทางปฏิบัติและเป็นจริงมากขึ้น ซึ่งมีความจำเป็นสำหรับการจำหน่ายผลิตภัณฑ์อาหารที่เติมหรือเคลือบด้วยไคโตแซน
อ้างอิง
ดนัย บุณยเกียรติ และ พิมพ์ใจ สีหะนาม. ผลของการเคลือบผิวด้วยไคโตแซนต่อคุณภาพของผลสตรอเบอรี่. วารสารเกษตร, 2546, ปีที่ 19, ฉบับที่ 2, หน้า 100-106.
นภาพร เชี่ยวชาญ และ ธนารัตน์ ศรีธุระวานิช. ไคโตแซนกับการยับยั้งจุลินทรีย์ในอาหาร. อาหาร, เมษายน-มิถุนายน, 2547, ปีที่ 34, ฉบับที่ 2, หน้า 120-124.
บุญศรี จงเสรีจิตต์, ผุสดี นาคพลายพันธุ์ และสุวบุญ จิรชาญชัย. การยับยั้งแบคทีเรียในอาหารโดยไคโตแซน : Antibacterial activity of chitosan against
food
microorganisms.
วารสารวิทยาศาสตร์, มีนาคม-เมษายน, 2547, หน้า 88-94.
Caner, C. and Cansiz, O. Effectiveness of chitosan-based coating in improving shelf-life of eggs. Journal of the Science of Food and Agriculture,
2007, vol. 87, no. 2, p. 227-232.
Devlieghere, F., Vermeulen, A., and Debevere, J. Chitosan : antimicrobial activity, interactions with food components and
applicability as a coating on fruit and vegetables. Food Microbiology, 2004, vol. 21, p. 703-714.
Fornes, F., et al. Low concentrations of chitosan coating reduce water spot incidence and delay peel pigmentation of Clementine mandarin fruit.
Journal of the Science of Food and Agriculture, 2005, vol. 85, no. 7, p. 1105-1112.
Galvagno, MA., et al. Exploring the use of natural antimicrobial agents and pulsed electric fields to control spoilage bacteria during a beer production process.
Revista Argentina de Microbiologia, 2007, vol. 39, p. 170-176.
Georgantelis, D., et al. Effect of rosemary extract, chitosan and -tocopherol on lipid oxidation and colour stability during frozen storage of beef burgers.
Meat Science, 2007, vol. 75, no. 2, p. 256-264.
Han, C., et al. Sensory evaluation of fresh strawberries (Fragaria ananassa) coated with chitosan-based edible coatings. Journal of Food Science,
2005, vol. 70, no. 3, p. 172-178.
Harish Prashanth, KV. and Tharanathan, RN. Chitin/chitosan : modifications and their unlimited application potential – an overview.
Trends in Food Science & Technology, 2007, vol. 18, no. 3, p. 117-131.
Kim, KM., et al. Properties of chitosan films as a function of pH and solvent type. Journal of Food Science, 2006, vol. 71, no. 3, p. E119-E124.
Lee, CH., Park, HJ., and Lee, DS. Influence of antimicrobial packaging on kinetics of spoilage microbial growth in milk and orange juice.
Journal of Food Engineering, 2004, vol.65, no. 4, p. 527-531.
Mi, FL., et al. Physicochemical, antimicrobial, and cytotoxic characteristics of a chitosan film cross-linked by a naturally occurring cross-linking agent,
aglycone geniposidic acid. Journal of Agricultural and Food Chemistry, 2006, vol. 54, no. 9, p. 3290-3296.
Moller, H., et al. Antimicrobial and physicochemical properties of chitosan-HPMC-based films. Journal of Agricultural and Food Chemistry,
2004, vol. 52, p. 6585-6591.
Nadarajah, K., et al. Sorption behavior of crawfish chitosan films as affected by chitosan extraction processes and solvent types.
Journal of Food Science, 2006, vol. 71, no. 2, p. E33-E39.
No, HK., et al. Applications of chitosan for improvement of quality and shelf life of foods : a review. Journal of Food Science,
2007, vol. 72, no. 5, p. R87-R100.
Suyatma, NE., Tighzert, L., and Copinet, A. Effects of hydrophilic plasticizers on mechanical, thermal, and surface properties of chitosan films.
Journal of Agricultural and Food Chemistry, 2005, vol. 53, p. 3950-3957.
Synowiecki, J. and Al-Khateeb, NA. Production, properties, and some new applications of chitin and its derivatives. Critical Reviews in Food Science and Nutrition,
2003, vol. 43, no. 2, p. 145-171.
Tsai, GJ, Zhang, SL., and Shieh, PL. Antimicrobial activity of a low-molecular-weight chitosan obtained from cellulase digestion of chitosan.
Journal of Food Protection, 2004, vol. 67, no. 2, p. 396-398.
Zivanovic, S., Chi, S., and Draughon, AF. Antimicrobial activity of chitosan films enriched with essential oils. Journal of Food Science,
2005, vol. 70, no. 1, p. M45-M51.